认识肝肺综合征
肝肺综合征(Hepatopulmonary Syndrome, HPS)是指肝功能不全患者因肺血管扩张、肺气体交换障碍导致的低氧血症及其一系列的病理生理变化和临床表现,又称基础肝病-肺血管扩张-严重低氧血症三联征。具体内容为:(1)有基础肝病,包括由各种病因引起的肝硬化、Wilson病、慢性肝功能不全,以及非肝硬化性门脉高压和肝外门静脉阻塞等;(2)有低氧血症,静息状态下呼吸,肺泡气-血氧分压差增大,伴有或不伴有CO2潴留;(3)存在肺动脉扩张。

一、 历史回顾
最早有关HPS的历史记载距今已有130多年的历史。1884年Flukiger等人首先报告1例37岁慢性肝病女性出现紫绀和杵状指,1956年,Kydelll等人报告1例17岁肝硬化患者,临床表现有进行性呼吸困难、肺血管分流和血氧饱和度下降,尸检发现存在多发性肺动-静脉瘘,1966年,Berthelot等人证明肝硬化患者存在肺内小动脉异常扩张,称为肺蜘蛛痣,1977年Kennedy和Knudson提出肝肺综合征的名称,1986年,Silverman等提出紫绀-杵状指-肝病综合征的名称, 1994年Krowa和Cortese把肝脏疾病、肺泡动脉氧分压差增加和肺血管扩张临床三联症定义为HPS。
二、 发病机制和病理
1. 低氧血症 HPS的低氧血症主要是由于通气灌注(VA/Q)比例失调、肺内分流和氧弥散受限三方面的因素所致。其根源在肺血管扩张,由于肺内血管扩张,肺血管失去低氧收缩的功能,导致VA/Q比例失调。肝病越重,VA/Q失调越明显;加上流体静力作用,肺底部血管优先灌注,而肺血管扩张多发生于中下肺野,因此从平卧位转至直立位时更易导致VA/Q失调,引发直立位低氧。肺内分流大多由肺血管扩张、血流加快及高灌注低肺泡通气所致的“功能性”分流,少数可由肺动静脉直接交通所致的“解剖性”分流。氧弥散限制理论认为,由于肺毛细血管扩张,直径增大以致于邻近肺泡内的氧分子不能全部弥散到毛细血管血流中间与其中的红细胞内血红蛋白氧合;加之肝病时的高动力循环状态使血流加快,氧合作用时间减少,更进一步损害红细胞内血红蛋白的氧合作用。
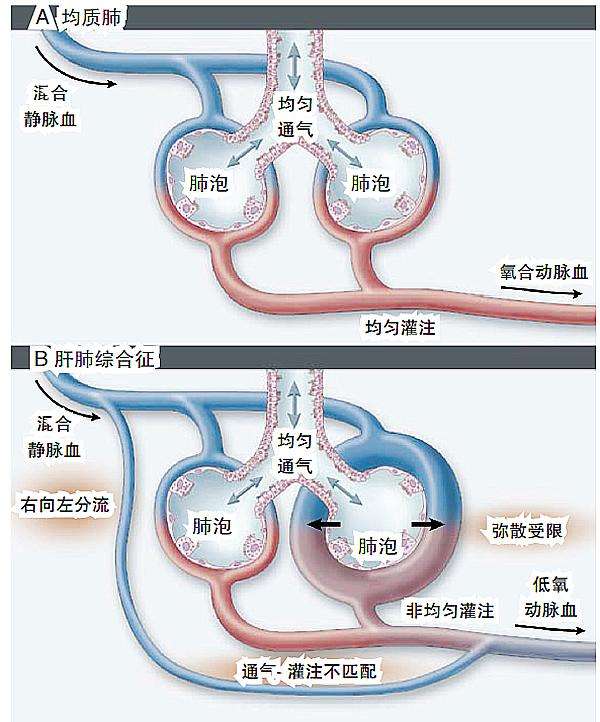
2. 肺血管扩张 肺内血管扩张的发生可能与肺血管扩张物质在肝功能不全时不能被灭活、或经门-体分流和淋巴通道进入肺循环有关,但究竟是哪一种物质在HPS发病中起直接介导作用尚不清楚。越来越多的研究认为,肺内血管扩张与血管收缩因子的缺乏或活性抑制,肺血管对血管扩张因子敏感性升高及与机体的特异体质有关。
3.NO的作用 1991年,Vallance根据NO的舒张血管效应预言,NO在肝硬化的高动力循环状态中起重要作用,NO含量升高与患者肺泡-动脉氧梯度(AaDo2)的上升成正相关,与心脏指数成负相关。HPS肺内NO生成增多的原因尚未完全阐明。有研究表明,肺内NO生成增多不是内毒素诱导iNOS活性增强的结果,而是肺内eNOS活性增强的结果。eNOS活性增强与低氧血症、过度通气、AaDo2增加、对新福林反应降低等病理生理改变密切相关,这些改变都可被NOS抑制剂所逆转。
目前已经确信NO在HPS发病机制中起重要作用,但有关eNOS合成增多的原因和其它细胞因子与NO生成增加间的关系尚未阐明,还需进一步研究。

4.内皮素的作用 有学者对慢性胆总管结扎的肝硬化动物模型研究发现,肺内eNOS水平与血浆内皮素水平呈正相关,肝组织与血浆内皮素均增高,而门静脉结扎后所致的肝前性门脉高压则缺乏上述变化;对门静脉结扎模型静脉灌注内皮素,其肺内eNOS的表达与其蛋白质产物增加,内皮素水平与肺内血管扩张和肺泡-动脉血氧差呈正相关,提示内皮素在HPS的发病机制中起着重要作用。
5.病理改变 HPS的基本病理改变为肺血管扩张,可为弥漫的大量前毛细血管扩张或孤立的动静脉交通支,以前者多见。肝硬化或严重肝衰竭患者尸检可发现肺循环紊乱,表现为混合的静脉血直接通过肺动静脉吻合支进入肺静脉。常见结构变化是近气体交换区域的前毛细血管水平血管床广泛扩张,在远离处也可见到大动静脉吻合支。

三、临床表现
HPS的临床表现包括三个方面,即基础肝病、低氧血症和肺损害。肝病的临床表现有各种消化道症状、肝掌、蜘蛛痣、消化道出血、食道静脉曲张、腹水、低蛋白血症、肝脾肿大和下肢水肿等。低氧血症和肺损害的临床表现为,口唇和甲床紫绀、呼吸困难、杵状指、直立性低氧血症。皮肤蜘蛛痣的出现提示存在体循环和肺血管扩张。直立性低氧血症则是HPS的重要特征之一。

四、辅助检查
实验室检查
(1)血气分析 血气分析是诊断HPS的重要手段,检查常见PaO2 明显下降。慢性肝病终末期患者至少有30%出现轻、中度低氧血症。在不伴有心脏疾病时出现严重低氧血症时,常提示存在HPS。(2)肺功能测定 HPS患者可出现闭合气量(CV)和闭合总量(CC)的增加。(3)心功能测定 HPS患者常可发生心输出量增加(>7L/min)。经心导管检查可发现肺动脉压正常或降低,肺血管阻力降低。
2.影像学检查 确定肺血管扩张主要靠影像学诊断,它是诊断HPS的关键。而经胸或食道的心脏声学造影正在成为主要的诊断方法。
(1)胸部放射学检查 57%的患者有肺容积降低,19.3%的患者有胸腔积液,18.3%的患者有肺底部血管纹理增粗,呈花斑状。
(2)对比-增强超声心动图 该法利用靛氰绿或震荡过的生理盐水产生的微气泡进行超声增强对比,从而使右心循环系统回声减弱。正常情况下,靛氰绿或气泡流经肺血管床时将会渗出血管而不出现在左心池,若发生肺部毛细血管扩张或右向左心分流,则可出现左心池的回声减弱。
(3)肺灌注扫描显像 99 m Tc-MAA动态肺灌注显像也是诊断肝原性肺血管扩张敏感而有效的方法之一。由于99 m Tc-MAA的直径为20μm,不能流经正常肺毛细血管(直径8-15μm),而当肺血管扩张或肺动静脉短路时,肺部放射性明显降低,左心和其他器官的放射性明显增强。
(4)肺血管造影 该项检查具有一定的危险性,应注意掌握适应证,若PaO2<150mmHg,可进行该项检查以确定是否有解剖上的动静脉短路。(5)CT检查 可显示有血管扩张的表现。

五.诊断及诊断标准
门脉高压患者若临床表现有蜘蛛痣、杵状指时应警惕有HPS的可能性。肝硬化患者有明显乏力或呼吸困难也应针对HPS作相应检查。HPS尚无统一的诊断标准,一般标准有:(1)慢性肝脏疾病;(2)PaO2<70mmHg或肺泡-动脉氧梯度>20mmHg;(3)肺内血管扩张。同时应注意与肝病患者并发或伴发成人呼吸窘迫综合征、胸腔积液、慢性阻塞性肺病或原有先天性心脏病等所致的低氧血症鉴别。

六. 治疗
1. 一般治疗 治疗原发病,包括纠正低蛋白血症,消除胸腹水,改善肝功,治疗并发症。同时避免剧烈运动和突然快速起立,减少机体的需氧量。
2.吸氧 轻症患者,早期经鼻导管低流量吸氧即可纠正低氧血症,而重症患者,单纯吸氧疗效较差。当处于低氧血症临界值(PaO2 9 Kpa左右),患者活动甚至睡眠时血氧饱和度很可能低于85%,此时即需给氧(2~3L/min)。有些患者需要正压给氧,高频通气或高压氧仓对改善患者的低氧血症也有益。

2.药物治疗 药物治疗有限。
奥曲肽 为生长抑素类似物,可阻断神经肽对肺血管的扩张作用,也可通过抑制胰高血糖素来减轻肺血管扩张。
β-肾上腺受体阻滞剂 逐渐加量,至心率降到用药前的75%为宜。不可突然停药,否则可能诱发心脏骤停。
雌激素拮抗剂 有蜘蛛痣的患者易发生HPS,患者血浆中的雌二醇/游离睾酮的比值显著高于正常人,故认为雌激素拮抗剂(如他莫惜芬)治疗HPS有效。
依前列醇(Epoprostenol) 具有肺动脉血管扩张作用和抗血小板集聚活性。
3.手术治疗 I型HPS可行肝移植,II型HPS可选用肺异常血管“圈状弹簧”栓塞术,据报告,术后动脉氧分压可提高2.0kPa。现在一般认为,PaO2 <50mmHg、肺内分流大于30%时,应列为肝移植的禁忌症;PaO2 <70 mmHg、且患者对吸氧反应良好,可以考虑肝移植。

七.预后
HPS预后不良,未经治疗的患者从起病到死亡平均时间是3年,死因依次为呼吸衰竭、多器官衰竭和胃肠道出血。Maya医院曾报告22例HPS,在发生HPS及出现相关症状后,有41%患者平均在1年半内死亡,死因为胃肠道出血、肾衰和脓毒血症。

热门文章
版权声明:本平台所有注明“原创”的作品,版权归“医牛”所有,未经书面授权,任何媒体、网站和个人禁止进行转载、摘编、复制等任何使用,未经授权使用将承担相应法律责任。授权转载时须注明“来源; 医牛健康资讯网”。本平台所有转载文章系出于传递更多信息之目的,且明确注明来源和作者,不希望被转载的媒体或个人可与我们联系,我们将立即进行删除处理。图片均来自于网络,版权属于原作者。
